Fisica dei Sistemi Biologici
Simulazioni multi-scala
Mutazioni oncogene

Aggregati e Parkinson

Fratassina, Fe e insorgenza di tumori
Proteine intrinsecamente disordinate: approcci computazionali multi-scala
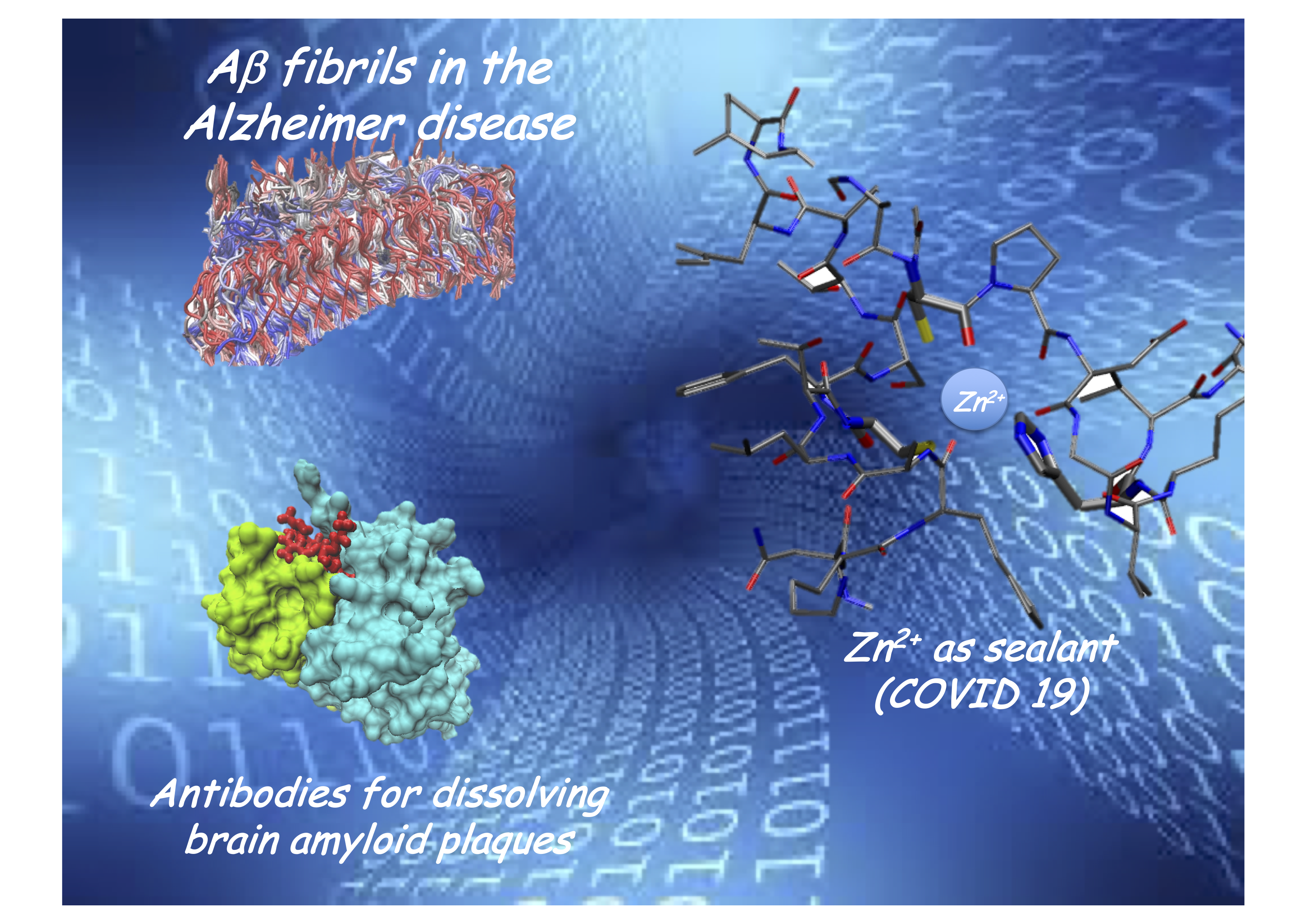
L'errato folding (mis-folding) di specifiche proteine è all'origine dell'insorgere delle Protein Conformational Diseases (PCDs). Sono note circa 50 PCDs incluse tutte le malattie neurodegenerative. Il mis-folding è un processo ancora poco compreso. Tra i molti approcci sviluppati per fare luce su cause e decorso delle PCDs, quello numerico ha dato negli anni risultati importanti. Lo studio del mis-folding richiede un approccio "multi-scala". Infatti, se da una parte i sistemi di interesse sono composti da O(106-7) atomi, dall’altra calcoli ab initio sono spesso indispensabili (per esempio, in presenza di metalli). L’approccio multi-scala permette di studiare sistemi con O(106) gradi di libertà e tempi di simulazione O(microsec) (Coarse-Grained Martini) in cui però importanti informazioni possono essere perse e recuperate con la dinamica molecolare classica (Gromacs) che da accesso a sistemi con O(105) atomi e tempi O(nsec), limitando i calcoli ab initio (Quantum-Espresso) a sistemi con O(103) atomi e per tempi di simulazione O(psec). La nostra IS BioPhys (INFN) ha accesso alle piattaforme HPC del CINECA.
Tumori e patologie da infezioni virali
L’obbiettivo principale del progetto PRIN-2017 (MIUR-PRIN-201744NR8S), di cui il gruppo di Biofisica è uno dei nodi, è fornire in modo sistematico una stima delle differenze di affinità per il target (DDG = DGmutata-DGwild-type) tra proteine native (wild-type) e proteine mutate (nsSNV). L'impatto di sostituzioni di singoli amino acidi sull'affinità di proteine verrà determinato con simulazioni di dinamica molecolare di non equilibrio ispirate al metodo di Jarzynski. I risultati numerici verranno confrontati con dati sperimentali sulle costanti di reazione e l’entalpia di legame che si otterranno in esperimenti SPR, ITC e NMR. Il primo passo nello sviluppo del progetto sarà lo studio delle interazioni della Calmodulina wild-type e di 16 delle sue mutazioni, che sono note essere associate all’insorgenza di tumori, con alcuni ricettori specifici che si trovano nelle cellule dei muscoli scheletrici.
Diffrazione da fibrille: alfa-sinucleina e Parkinson
La malattia di Parkinson colpisce circa il 3% della popolazione sopra i 70 anni. Attualmente esistono solo terapie sintomatiche, ma l’aumento dell’aspettativa di vita richiede un rinnovato sforzo per trovare cure efficaci. L'accurata conoscenza delle basi molecolari della malattia è un prerequisito indispensabile per lo sviluppo di nuove terapie. Si ritiene che l’alpha-sinucleina nella sua forma aggregata sia coinvolta nell’ insorgenza dei processi neurodegenerativi. Misure di diffrazione condotte all’European X-FEL permetteranno di ottenere informazioni strutturali sugli aggregati fibrillari (ottenuti da cervelli di pazienti) e associarle alla risposta a varie immunoterapie. Uno studio di fattibilità è in corso presso il sincrotrone Elettra di Trieste.
Wild-type e mutanti della Frataxina umana
Mutazioni della Fratassina (FXN) o una sua insufficiente produzione sono ritenuti responsabili di un accresciuto livello di insorgenza di tumori e dello sviluppo di una grave malattia neurodegenerativa, l’atassia di Friedreich. Nella FXN sono stati identificati tre siti di legame per il Fe, uno dei quali è situato in una regione disordinata della proteina. Con un progetto finanziato da ESRF si intende studiare, mediante XAS (X-ray Absorption Spectroscopy), l’effetto che le mutazioni puntuali della FXN riscontrate nelle cellule tumorali hanno sul suo legame con il Fe e quindi sulla formazione di oligomeri. Le misure XAS saranno integrate con altri dati sperimentali e completate da simulazioni ab initio e di dinamica molecolare classica.